大家好,本周为大家分享一篇2023年发表在Journal of the American Chemical Society上的文章,μMap Photoproximity Labeling Enables Small Molecule Binding Site Mapping1。该文章的通讯作者是来自美国普林斯顿大学化学系的David W. C. MacMillan教授。
目前,药物发现主要分为两种方式:基于靶点的药物研发(Target-based drug discovery,TDD)和基于表型的药物筛选(Phenotypic drug discovery, PDD)。表型筛选主要是在细胞或动物水平开展实验,因此蛋白靶点以及蛋白-配体结合模式一开始就是未知的,如何在确定活性分子后快速地找到其作用通路、靶点、结合位点、结合模式(正构/别构)一直以来都是众多研究员所关心的问题。常规的蛋白质组学差异性分析能够帮助我们快速确认作用通路、发现潜在靶点,但却缺少更精细的结构信息。光亲和标记(Photoaffinity Labeling)能够有效地补充这方面的信息,将PAL探针靶向交联至靶蛋白结合口袋,再利用LC-MS去寻找标记位点或肽段,从而提供肽段或残基分辨率的结合位点信息。然而,由于PAL探针与蛋白是按照一定的化学计量比进行结合的,所以产生的标记信号和序列覆盖都非常有限。除此之外,每个PAL探针都有不同的二级碎裂模式,使质谱分析复杂化。基于此,David W. C. MacMillan团队开发了一种稳健且通用的光催化标记方法来定位蛋白结合位点。
如图1B所示,活性分子上连接有具有光催化功能的标签(Catalytic tagging),本文使用的是铱光催化剂。活性分子-铱光催化剂偶联物能够靶向至蛋白的结合口袋,在可见光的照射下,铱通过能量转移的方式催化附近的双吖丙啶探针生成卡宾自由基,卡宾自由基能够与邻近的氨基酸残基发生反应,从而实现结合口袋的邻位标记。值得一提的是,这种独特的μMap光催化临近标记法将靶向定位和邻近标记分配给不同的分子去完成,邻位标记不受限于靶向定位所需要满足的化学计量比的要求,可实现多个邻近位点的标记,具有信号放大的效果。此外,所有活性分子-铱光催化剂偶联物都可以配合使用统一的邻位标记探针,具有一致二级碎裂模式,有助于简化后续LC-MS数据分析。
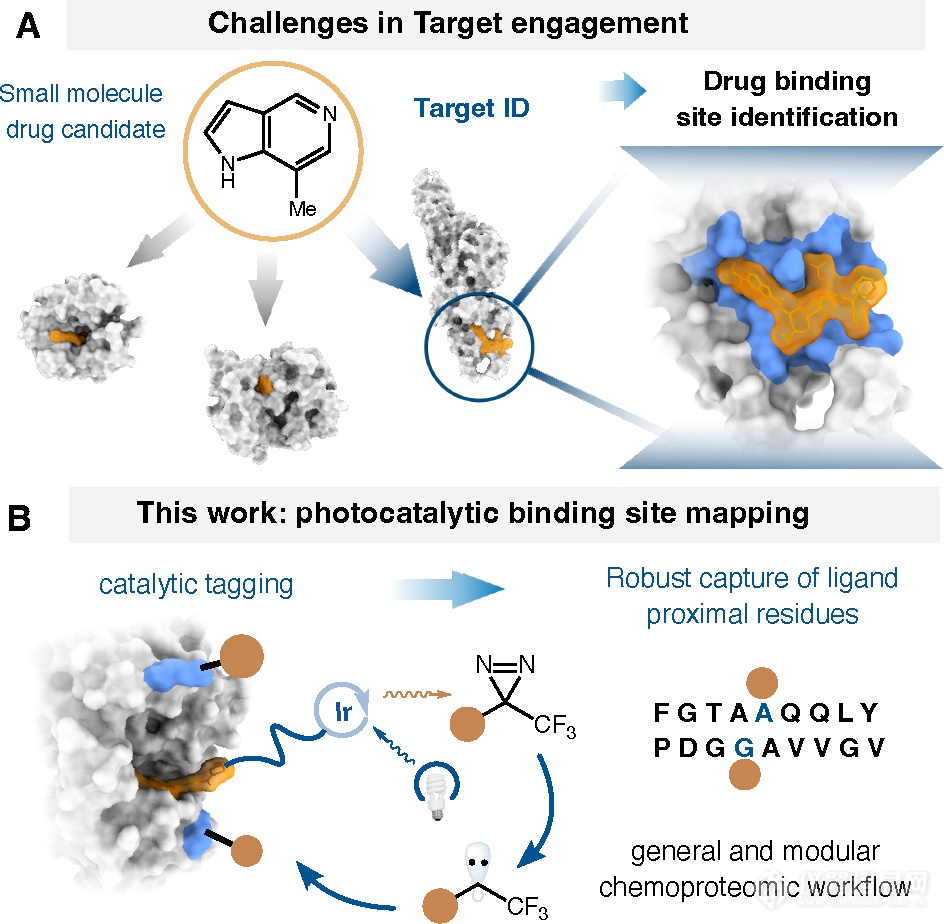
图1 μMap光催化邻近标记法原理
为了确认该方法的选择性标记能力,作者以牛碳酸酐酶(CA)为例,探究磺胺类抑制剂-铱催化剂偶联物(图2A sulfonamide-Ir (1))能否触发CA上邻近结合位点的选择性标记。将CA与BSA蛋白按照1:1混合,向中加入sulfonamide-Ir,随后加入带有生物素标签的邻位标记探针(图2A Diazirine-PEG3-biotin(2)),根据Western blot的结果可知(图2B),sulfonamide-Ir (1)的加入触发了CA上的选择性标记,相比于未开启光照以及直接加入free-Ir的两组样品,加入sulfonamide-Ir的样品中CA条带明显变深,说明此条件下,CA上有较多的带有生物素标签的标记位点。
随后,作者对样品进行柱上酶切,利用LC-MS鉴定标记肽段、定位标记位点(图2C-E)。值得注意的是,为了获得高置信度的标记残基信息,作者将free-Ir设置为对照组,通过统计sulfonamide-Ir组与free-Ir组中同一标记肽段信号强度的倍差变化(fold change)以及显著性差异分析,筛选出最可靠的标记位点。此次实验结果显示,邻近标记位点为Q135和H2,将其映射至CA的晶体结构上可知两个位点距离磺胺类小分子与CA的结合位点分别17和11Å,说明μMap光催化临近标记法在小分子结合位点的鉴定上是准确且可靠的。
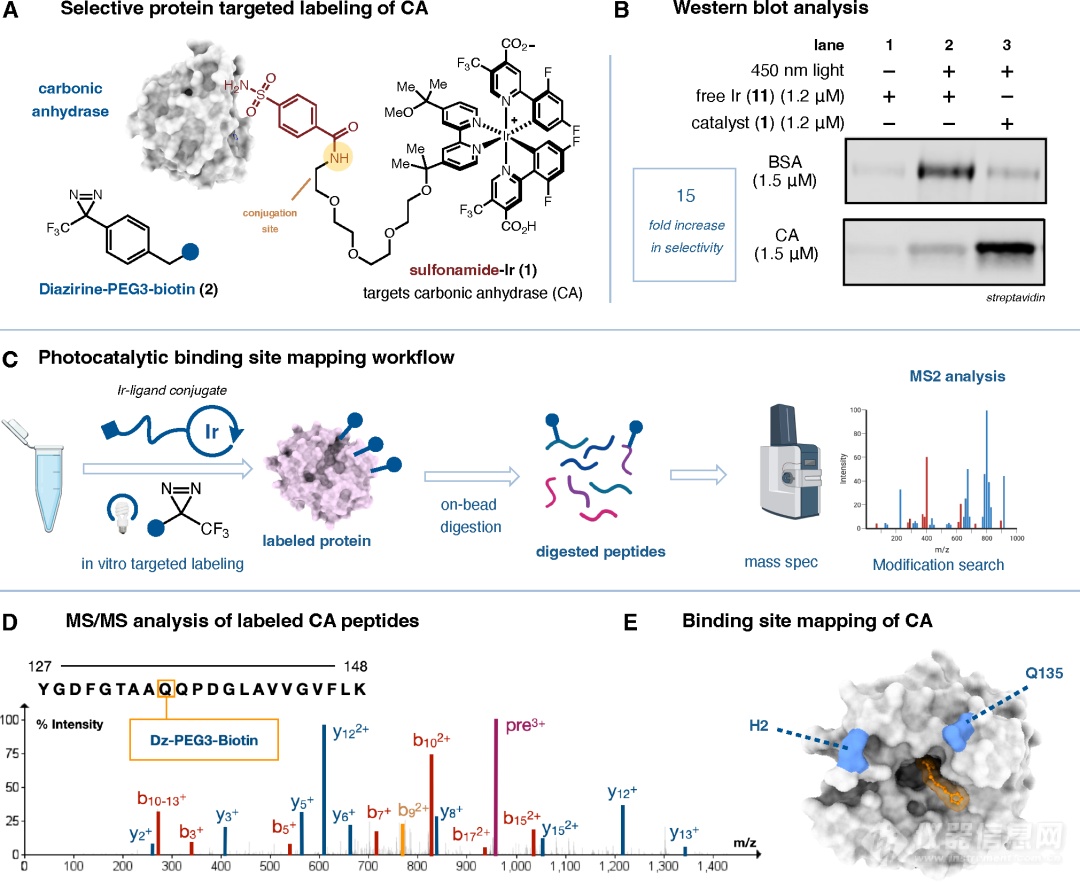
图2 μMap光催化邻近标记法用于sulfonamide-CA结合位点的表征。为了展现μMap光催化临近标记法的普适性。作者将该方法应用到了其它一些蛋白-配体复合物模型上,如:(+)-JQ-1与BRD4(图3A)、dasatinib与BTK(图3B)、AT7519与CDK2(图3C)和lenalidomide与CRBN(图3D),以上实验均获得符合预期的结果。此外,作者还将μMap光催化临近标记法应用到了分子胶rapamycin介导的FKBP12-rapamycin-mTOR蛋白复合物结合界面的表征,展现了该方法“穿越空间”的结构表征能力,从蛋白FKBP12与小分子rapamycin互作到小分子rapamycin与蛋白mTOR的互作,描绘了整个结合界面的轮廓(图3E)。
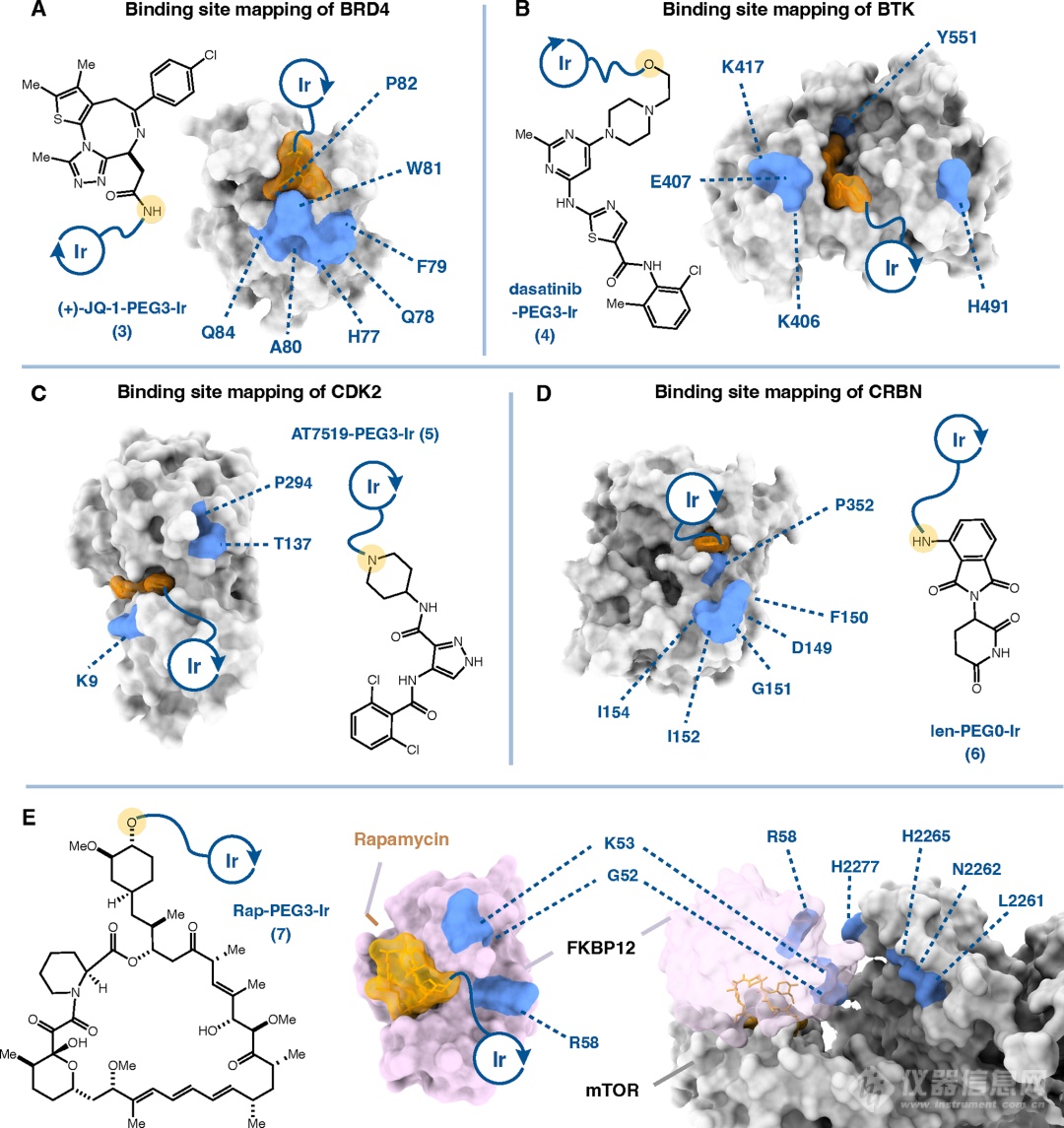
图3 μMap光催化邻近标记法用于A)(+)-JQ-1与BRD4;B)dasatinib与BTK;C)AT7519与CDK2;D)lenalidomide与CRBN;E)FKBP12-rapamycin-mTOR蛋白复合物结合位点的鉴定。
以上均是在已知结合位点的蛋白-配体模型中开展的方法学验证实验,后续作者还将μMap光催化临近标记法应用到难成药靶点STAT3。MM-206是STAT3的小分子抑制剂,在临床前疾病模型研究中显示出较好的抗STAT3活性,但到目前为止还没有STAT3与MM-206结合的晶体结构报道,也没有关于MM-206与STAT3结合位点的信息。
在本文中,μMap光催化临近标记的结果显示MM-206主要是结合在STAT3的CCD结构域上,大致在Q198和V291位点附近,属于一种变构调节剂(图4A-B)。最后,作者进一步探究了μMap光催化临近标记法在活细胞水平上的标记能力。如图C-E,使用μMap光催化临近标记法成功找到了(+)-JQ-1的结合蛋白:BRD2、BRD3及BRD4,并定位到了(+)-JQ-1与BRD4结合位点,大致在V90、K91、W81氨基酸残基附近。
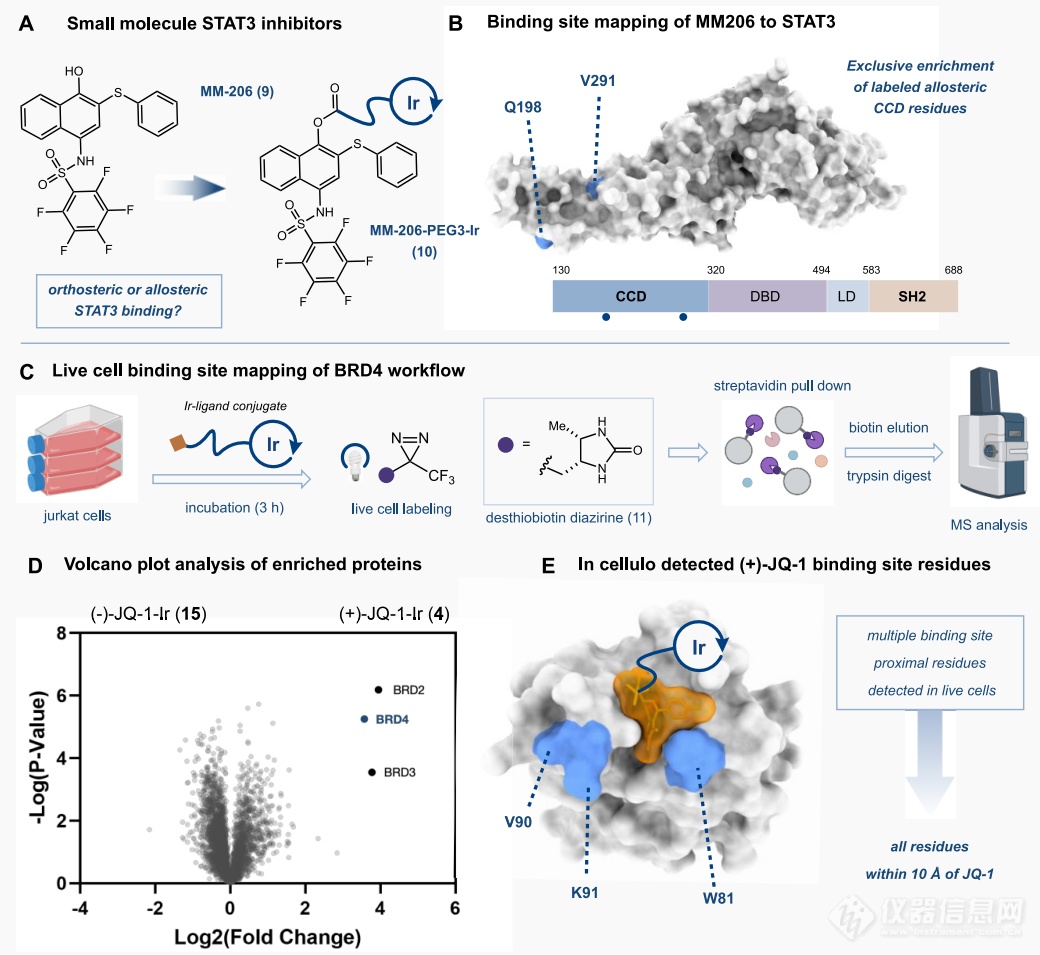
图4 μMap光催化邻近标记法用于A-B)MM-206与难成药靶点STAT3结合位点的鉴定;C-E)组学样品中小分子(+)-JQ-1结合蛋白的鉴定及结合位点的锁定。
总之,本文开发了一种通过标记近端残基来绘制小分子结合位点的通用方法。该方法已被证明适用于一系列小分子配体-蛋白质、多蛋白质复合物和“不可成药”的靶点蛋白的互作表征,从单一蛋白到组学层面均展现出良好的应用前景。
撰稿:刘蕊洁
编辑:李惠琳
原文:μMap Photoproximity Labeling Enables Small Molecule Binding Site Mapping
参考文献
Huth SW, Oakley JV, Seath CP, et al. μMap Photoproximity Labeling Enables Small Molecule Binding Site Mapping. J Am Chem Soc. 2023;145(30):16289-16296.
